núcleo da célula
Uma das principais características da célula eucariótica é a presença de um núcleo de forma variável, porém bem individualizado e separado do restante da célula. Ao microscópio óptico, o núcleo tem contorno nítido, sendo o seu interior preenchido por elementos figurados. Dentre os elementos, distinguem-se o nucléolo e a cromatina. O núcleo é isolado do meio citoplasmático através do envelope nuclear.
 |
| Note os núcleos dos neurônios, com os nucléolos bem conspícuos. |
ENVELOPE NUCLEAR
 |
| Visão esquemática da continuidade do envelope nuclear com o sistema de endomembranas celulares (retículo endoplasmático rugoso e liso) |
O envelope nuclear, anteriormente denominado carioteca, é diretamente conectado à extensa rede de membranas do retículo endoplasmático e é sustentado por redes de filamentos, a lâmina nuclear, formada por proteínas, e as laminas. Uma das funções do envelope nuclear deve ser a de proteger as longas e frágeis moléculas de DNA das forças mecânicas geradas pelos filamentos citoplasmáticos em eucariotos. O envelope é uma membrana dupla contendo um espaço, a cisterna perinuclear. O envelope é descontínuo. Nele, observam-se poros, guarnecidos por um complexo de poro, altamente seletivo, cuja função é captar as proteínas destinadas ao núcleo e permitir o trânsito dos RNAs para o citoplasma, bem como de íons, outras moléculas e complexos moleculares, nos dois sentidos.
O que se vê ao microscópio óptico como envoltório nuclear é, principalmente, a camada de cromatina que o reveste internamente. O microscópio eletrônico mostrou que o envoltório nuclear é constituído por duas membranas separadas por um espaço de 40 a 70 nm, a cisterna perinuclear. A membrana nuclear externa contém polirribossomos presos à sua superfície citoplasmática e é contínua com o retículo endoplasmático rugoso. Como citamos, o envoltório nuclear apresenta poros. A função do complexo do poro é o transporte seletivo de moléculas para fora e para dentro do núcleo. No poro, as duas membranas que constituem o envoltório nuclear são contínuas. O envoltório nuclear é impermeável a íons e moléculas, de modo que o trânsito entre o núcleo e o citoplasma é feito somente via complexo de poro.
O complexo de poro é uma estrutura cilíndrica, constituída por mais de 100 proteínas, de contorno octogonal, que faz saliência no interior e na face citoplasmática do núcleo. Apresenta diâmetro externo de aproximadamente 120 nm e um canal central com 9 nm. Possui filamentos móveis virados para o citoplasma que atraem determinadas moléculas. O canal, e ao mesmo tempo o sistema de ancoragem no envelope, é feito por um domínio composto por oito raios que estão inseridos na membrana do núcleo e que rodeiam o canal central por onde são transportadas as moléculas. Na face intranuclear, observamos o cesto nuclear, que “recebe” o material proveniente do citoplasma. Este tem também a capacidade de abrir ou fechar a fim de controlar a importação.
O poro tem a capacidade de selecionar os compostos que devem ou não entrar, através de um “sinal” que se liga ao composto que é reconhecido pelo núcleo. Apenas os compostos com tamanho inferior a 20/40 kDa circulam por difusão. Íons e moléculas medindo 9 nm passam livremente pelo complexo de poro nuclear, por difusão passiva. Moléculas e complexos moleculares com mais de 9 nm são transferidos por transporte ativo, um processo mediado por receptores que requer energia derivada da hidrólise de adenosina trifosfato (ATP) e se realiza em duas etapas. Na primeira, proteínas com um ou mais sinais de destinação nuclear ou NSL (Nuclear Signal Location) se ligam a proteínas específicas do citosol, formando um complexo que adere temporariamente à periferia do poro nuclear, sem gasto de energia.
Na segunda etapa, as moléculas proteicas com um ou mais NSL são transportadas para dentro do núcleo, usando a energia de ATP, e a proteína citossólica permanece no citoplasma. Provavelmente, parte da energia do ATP é gasta para dilatar o canal do poro durante a passagem de molécula ou complexo molecular com mais de 9 nm.
O transporte auxiliado pela importina β desenvolve-se ao longo do poro graças à crescente afinidade entre as nucleoporinas, proteínas do poro, e o complexo β-carga (β-C). Esse complexo, inicialmente, é atraído para a nucleoporina que se encontra nos filamentos (também conhecida como nup358), onde sofre uma atração mais forte pelo complexo nucleoporina62 (nup62) e deste pela nucleoporina153 (nup153). Dada a elevada afinidade entre o complexo β-C e a nup153, é necessária a intervenção de uma enzima, a RanGTP, quebrando a ligação entre o complexo e a carga e libertando-a para o núcleo.
Sabe-se hoje que a importina só tem afinidade para os NLS quando ligada à RanGDP, e que quando esta se encontra fosforilada (RanGTP) não ocorre qualquer ligação com proteínas. No núcleo, a libertação da proteína ocorre quando a enzima RanGEF fosforila RanGDP, transformando-a em RanGTP, com gasto de energia. Sabe-se que a afinidade não é fixa e é influenciada pela presença de alguns compostos. Um exemplo desses compostos é o RanGTP, que condiciona a percentagem de importina que se liga às diferentes nucleoporinas.
Em íntima associação com a face interna do envoltório nuclear, exceto na altura dos poros nucleares, encontra-se uma estrutura constituída por uma rede de moléculas proteicas fibrosas, a lâmina nuclear,
que estabiliza o envelope nuclear e apoia os cromossomos interfásicos. Durante a interfase, o segmento de cromatina se prende à lâmina nuclear, mostrando que os cromossomos interfásicos não estão dispostos ao acaso, mas têm localização precisa dentro do núcleo.
que estabiliza o envelope nuclear e apoia os cromossomos interfásicos. Durante a interfase, o segmento de cromatina se prende à lâmina nuclear, mostrando que os cromossomos interfásicos não estão dispostos ao acaso, mas têm localização precisa dentro do núcleo.
A lâmina nuclear é uma malha bidimensional formada por proteínas filamentosas (as laminas nucleares) que integram a família dos chamados filamentos intermediários. Diferentemente dos microtúbulos e da actina, os filamentos intermediários deformam-se facilmente, mas são capazes de sustentar grandes tensões sem se romper. A lâmina nuclear localiza-se subjacente à membrana nuclear interna do envoltório nuclear, fornecendo suporte estrutural para o núcleo.
As laminas nucleares estão presentes nas células de mamíferos pelo menos sob 4 formas diferentes: laminas A, B1, B2 e C. Elas encontram-se associadas com a membrana nuclear interna e com proteínas integrais da membrana nuclear interna e dos poros nucleares, o que auxilia a organização dos filamentos em uma rede. Além disso, a lâmina nuclear atua como um sítio de ligação da cromatina, que se encontra organizada em grandes alças de DNA. As laminas podem mediar a interação de pelo menos algumas dessas alças ao envoltório nuclear.
Durante a mitose, os cromossomas se condensam, o nucléolo aparentemente, ao microscópio de luz, desaparece e o envoltório nuclear se dissocia, causando a liberação dos componentes nucleares no citoplasma. Na maioria das células, essa desmontagem do envoltório nuclear marca o final da prófase, ocorrendo, simultaneamente, a um rompimento similar do retículo endoplasmático.
As membranas nucleares fragmentam-se em vesículas, os complexos de poros nucleares dissociam-se, e a lâmina nuclear despolimeriza-se. Catalisada pela proteína quinase Cdc2, um regulador central da mitose, a fosforilação de todos os tipos de laminas resulta na desmontagem da lâmina nuclear pela separação dos dímeros individuais dessas proteínas. Simultaneamente, ocorre a fragmentação da membrana nuclear em vesículas, permanecendo as laminas tipo B associadas a essas vesículas.
As laminas do tipo A e C são liberadas como dímeros livres no citosol. Os complexos de poros nucleares também se dissociam em subunidades como resultado da fosforilação de várias proteínas do poro nuclear.
Proteínas integrais da membrana nuclear também são fosforiladas na mitose, o que é importante tanto para a formação de vesículas como para a dissociação da membrana nuclear dos cromossomas e da lâmina nuclear.
A progressão da metáfase para a anáfase envolve a ativação da ubiquitina, que inativa a Cdc2, degradando sua subunidade regulatória, a ciclina B. A inativação da Cdc2 resulta na desfosforilação de todas as proteínas mencionadas anteriormente, na saída da mitose e na nova formação do núcleo interfásico. As vesículas formadas no fim da prófase ligam-se à superfície dos cromossomas, num processo mediado pelas laminas e por proteínas integrais da membrana nuclear interna. Ocorre, assim, a fusão das vesículas e a formação de uma dupla membrana ao redor dos cromossomas, a união dos complexos de poros nucleares, a nova formação da lâmina nuclear e a descondensação dos cromossomas.
Inicialmente, as vesículas formam membranas ao redor de cromossomas individuais, seguindo-se a fusão dessas vesículas individuais para formar um núcleo único completo. O processo de formação do envoltório nuclear exclui as moléculas citoplasmáticas do núcleo, que se expande pela importação das mesmas proteínas nucleares que foram liberadas no citoplasma, após a desmontagem do envoltório nuclear. O nucléolo se refaz com a descondensação dos cromossomas e a transcrição dos genes de RNAr, concluindo a formação do núcleo interfásico.
Matriz Nuclear
Entre os grânulos de cromatina e o nucléolo existe a matriz nuclear. Esta funciona como um esqueleto ribonucleoproteico organizador do núcleo, à qual se associam ácidos nucleicos, enzimas e fatores reguladores do núcleo.
A lâmina nuclear é estabilizada por uma série de proteínas da matriz nuclear associadas a ela, como, por exemplo, a emerina. Essa proteína, rica em radicais serina, pertence a uma família de proteínas associadas à lâmina nuclear. Ela tem função bastante conhecida, em especial na musculatura esquelética, atuando, de fato, como estabilizadora do envelope e da lâmina nuclear na contração muscular. Ela liga-se a domínios da cromatina, integrando-se à espectrina nuclear e a outras proteínas integradoras, estabelecendo domínios cromatínicos bem definidos. Sua malformação caracteriza uma patologia denominada Distrofia Muscular de Emery-Dreyfuss, caracterizada pela geração de contraturas musculares frequentes e precoces, fraqueza muscular nos tendões de aquiles, nos ombros e na musculatura cervical posterior, progredindo a defeitos de condução cardíacos, como bradicardia sinusal, podendo evoluir a bloqueio atrioventricular completo.
Proteínas Nucleares da Matriz (NMP) apresentam uso clínico no diagnóstico de algumas patologias, como é o caso de tumores de bexiga. Trata-se de uma forma de monitorizar pacientes para recorrência do câncer de bexiga. Esse câncer é o quarto tumor em ordem de frequência em homens e o oitavo em mulheres nos Estados Unidos. Dos casos diagnosticados anualmente, 70 a 80% são confinados ao urotélio (estágio Ta ou Tis) ou invadem a lâmina própria (estágio T1), sendo agrupados como tumores superficiais. Entre 50 e 80% desses pacientes terão recorrência no primeiro ano e, aproximadamente, 25% das lesões pioram em relação ao grau, enquanto 10 a 15% das lesões T1 e 2 a 4% das lesões Ta evoluem para doença invasiva. Monitorar esses pacientes após o diagnóstico inicial e a ressecção, tradicionalmente, requer cistoscopias e ultrassonografias periódicas, além de avaliações citológicas urinárias. Os pacientes são regularmente avaliados a cada três meses nos dois primeiros anos, a cada seis meses nos dois anos subsequentes e, anualmente, por dez anos ou mais. A cistoscopia se mantém como o “padrão ouro” para o diagnóstico de lesões vesicais, tanto as recorrentes quanto as “de novo”. Infelizmente é um exame dispendioso, invasivo e desagradável para o paciente. Além disso, a especificidade do método é inferior a 10% quando utilizada na investigação de microematúria.
A partir dessa premissa, passamos a utilizar o conhecimento sobre as proteínas específicas da matriz nuclear. Uma delas é a NMP22. Ela está associada à replicação do DNA, síntese de RNA, ligação hormonal e expressão gênica. O teste para detectar essa proteína consiste em uma reação imunoenzimática que reconhece essas proteínas, encontradas em níveis elevados na urina de pacientes com câncer de bexiga. O teste do NMP22 quantifica as proteínas da matriz nuclear na urina, que em indivíduos normais é encontrada em diminutas quantidades. Uma única amostra é possível proporcionar uma medida acurada. Em geral, aceita-se o valor de 10 U/ml para screening em uma população sem antecedentes, porém em pacientes que estão sob vigilância devido a uma história
prévia de tumor vesical, alguns advogam o limite de 6,4 U/ml. Glas e cols. (2003) realizaram uma meta-análise que mostra que NMP22 tem melhor sensibilidade do que outras abordagens.
prévia de tumor vesical, alguns advogam o limite de 6,4 U/ml. Glas e cols. (2003) realizaram uma meta-análise que mostra que NMP22 tem melhor sensibilidade do que outras abordagens.
Já que essa diferença de sensibilidade é maior nos graus mais baixos e estágios prematuros, o uso de NMP22 pode facilitar a detecção precoce de recorrência. Além disso, um resultado de NMP22 negativa pode aumentar o intervalo entre as cistoscopias, devido ao aumento global da sensibilidade. Os níveis pós-operatórios de NMP22, colhidos pelo menos cinco dias após a RTU, poderiam prever a recorrência tumoral. Atualmente, kits para a detecção dessa proteína da matriz nuclear estão cada vez mais utilizados para prognosticar possíveis recidivas de tumores uroteliais da bexiga.
O retículo nucleoplasmático (RNP) foi identificado por uma equipe de pesquisadores da Universidade de Yale, nos Estados Unidos, em parceria com a Universidade Federal de Minas Gerais
(UFMG), que identificou e mostrou o funcionamento dessa nova estrutura, responsável por armazenar e liberar cálcio. A presença desse maquinário permite que vários processos sejam regulados de forma independente no núcleo. À semelhança do RER e REL, o RNP é formado por uma rede de túbulos ramificados e é responsável por armazenar e liberar cálcio iônico dentro do núcleo. O retículo nucleoplasmático é, de certa forma, correlacionado a outra estrutura celular de nome parecido: o retículo endoplasmático. Essas pequenas máquinas do interior de nossas células desempenham papel fundamental em todos os momentos de nossas vidas.
(UFMG), que identificou e mostrou o funcionamento dessa nova estrutura, responsável por armazenar e liberar cálcio. A presença desse maquinário permite que vários processos sejam regulados de forma independente no núcleo. À semelhança do RER e REL, o RNP é formado por uma rede de túbulos ramificados e é responsável por armazenar e liberar cálcio iônico dentro do núcleo. O retículo nucleoplasmático é, de certa forma, correlacionado a outra estrutura celular de nome parecido: o retículo endoplasmático. Essas pequenas máquinas do interior de nossas células desempenham papel fundamental em todos os momentos de nossas vidas.
Elas comandam a liberação do cálcio dentro das células. Todos sabem da importância do cálcio para dentes e ossos, mas o papel do elemento vai muito além. O cálcio, por encontrar-se dentro das células em níveis muito baixos, age como um “gatilho” biológico. Uma vez acionado na hora e na quantidade certas, ele ativa determinadas partes do DNA.
O cálcio regula os batimentos do coração, o movimento de braços e pernas, o piscar dos olhos, enfim, cada movimento de nossos músculos. E faz mais. Também está ligado, por exemplo, à liberação dos hormônios, como a insulina, e ao próprio ritmo de vida e morte das células. Dentro das células, o cálcio fica aprisionado em compartimentos.
Até agora se imaginava que cabia ao retículo endoplasmático soltar cálcio quando este fosse necessário. O estudo da UFMG e das universidades americanas mostra que o retículo endoplasmático faz isso apenas em parte da célula. No núcleo, onde está o DNA, quem coordena a liberação do íon é o recém-descoberto retículo nucleoplasmático. O cálcio fica armazenado, principalmente, dentro do retículo endoplasmático liso. Até se dar a descoberta, biólogos celulares acreditavam que o cálcio entrava no núcleo vindo do citoplasma através dos poros. Caso esse fosse o único meio de o cálcio entrar no núcleo, este ficaria sujeito a funcionar como um compartimento único e homogêneo. Ao contrário, como o núcleo é responsável por regular diversos processos simultaneamente, portanto, fica mais fácil compreender a função de um retículo que armazene e secrete cálcio dentro do núcleo, o que permite atender diferentes necessidades locais.
No núcleo, o cálcio deve regular, prioritariamente, a transcrição de alguns genes, que dependem desse elemento para ocorrer e até afetar a própria estrutura do DNA, segundo afirmam os autores da pesquisa. Embora o retículo nucleoplasmático não tivesse sido reconhecido anteriormente como sendo uma organela, já havia sido observado como sendo extensão do núcleo que estaria presente em
vários tipos de células dos mamíferos. Essa descrição se confirma, visto que o recém-descoberto retículo nucleoplasmático está fisicamente ligado tanto ao retículo endoplasmático quanto à membrana nuclear, ou envelope nuclear.
vários tipos de células dos mamíferos. Essa descrição se confirma, visto que o recém-descoberto retículo nucleoplasmático está fisicamente ligado tanto ao retículo endoplasmático quanto à membrana nuclear, ou envelope nuclear.
Nucléolo, Corpos de Cajal e outras estruturas intranucleares
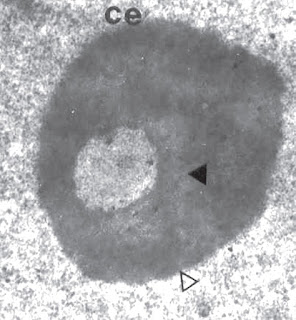 |
| Corpo de Cajal ou esférico (CE), com sua estrutura em anel. Fotomicrografia obtida pelo autor, espermatócito de B. microplus. |
- Parte amorfa: Contém grânulos de DNA.
- Parte densa: Se distinguem:
- Parte granular: Formada por agregados de grânulos de 25 nm de diâmetro que contêm ribonucleoproteínas.
- Parte fibrilar: Mais densa que a anterior, constituída por fibrilas de 8-10 nm também formadas por ribonucleoproteínas.
- Centro fibrilar: Muito evidente em alguns nucléolos; nele, podem haver vários centros fibrilares e de densidade inferior à das partes granular e fibrilar. Consiste em finas fibrilas de 7-9 nm. Contém DNA e algum RNA. Devido ao conteúdo em DNA, se considera que os centros fibrilares correspondem a organizadores nucleolares em fase ativa ou de transcrição. Outros autores lhe atribuem função de armazenamento de reservas proteicas para a síntese ribossômica.
Em muitos nucléolos, se observa uma massa fibrilar densa que contém exclusivamente DNA, que é a heterocromatina associada ao nucléolo, que corresponde à heterocromatina telomérica dos organizadores nucleolares.
A proporção de RNA no nucléolo é muito variável e depende do tipo celular e do estado funcional. Se estima como valor médio 10%, embora em algumas células possa alcançar 30%. Sempre se encontra 1-3% de DNA, que corresponde ao centro fibrilar e à heterocromatina associada ao nucléolo. O componente majoritário é composto de proteínas, que constituem praticamente o resto do nucléolo. Se trata de fosfoproteínas ácidas e outras proteínas muito diversas, algumas das quais são básicas. Entre as proteínas do nucléolo, se encontram as snRNP (ribonucleoproteínas nucleares pequenas), que intervêm na maturação do RNAr e ajudam na construção do ribossoma. Também se detectam enzimas, principalmente as necessárias para a síntese de RNA e seu processamento.
Como ocorre com os cromossomas, o comportamento do nucléolo é muito diferente, considerando células interfásicas ou mitóticas. Na interfase, não se observa grandes alterações no nucléolo. Pode ocorrer o aumento de seu volume, havendo tendência à fusão de nucléolos, o que ocorre quando dois organizadores nucleolares se situam próximos.
Durante a divisão celular, o nucléolo mostra uma série de alterações que determinam um tipo de conduta nucleolar: o ciclo mitótico típico do nucléolo. Este consiste fundamentalmente em três processos:
Desorganizacão profásica: É um processo em que o nucléolo apresenta diminuição de tamanho, forma irregular (polilobulada ou estrelada), diminuição da afinidade tintorial e aparição de pequenas massas de material nucleolar livres entre os cromossomas profásicos.
Transporte metafásico e anafásico: Nessa etapa o nucléolo perdeu sua individualidade. Seus constituintes se dispersaram pelo núcleo profásico e terminam incorporando-se aos cromossomas metafásicos.
Reorganização telofásica: Na primeira metade da telófase, aparecem corpos laminares entre os cordões cromossômicos em vias de descondensação. Ao mesmo tempo, se observa corpos mais esféricos, resultado da aglomeração e fusão dos menores. Esses corpos apresentam todas as características morfológicas e reativas próprias do nucléolo interfásico, denominando-se corpos prenucleolares.
Avançada a telófase, os corpos prenucleolares se fazem maiores e formam o nucléolo interfásico por coalescência e fusão. O ciclo nucleolar aparece ligeiramente atrasado em suas fases morfológicas em relação ao ciclo cromossômico. A desorganização profásica começa depois de iniciada a prófase e termina depois de iniciada a prometáfase.
A reorganização telofásica começa depois de iniciada a telófase e termina depois de iniciada a interfase. O organizador nucleolar é uma estrutura do cromossoma similar a uma constrição secundária do cromossoma metafásico, que na interfase formará um nucléolo em torno dela. Aparece como uma constrição telomérica, constituindo uma região de fibrilas pouco densas, mais frouxas que as da cromatina. Essa constrição possui proteínas semelhantes às do nucléolo. Ali temos fibras de cromatina empacotadas de forma diferente à do resto do cromossoma. O organizador nucleolar se encontra separado do resto da cromatina por heterocromatina telomérica. Não aparece em todos os cromossomas do cariótipo de uma espécie, somente em alguns (Cromossomas 13, 14, 15, 21 e 22 do cariótipo humano).
Nos ovócitos de muitas espécies de anfíbios, peixes, moluscos, insetos e helmintos, que necessitam de uma ativa síntese proteica para acumular substâncias de reserva, o DNA dos organizadores nucleolares se replica muitas vezes (amplificação genética). Essas duplas hélices emigram até a periferia nuclear, onde formarão nucléolos, podendo fusionar-se e originar outros maiores. Ao final da ovogênese, cessa a transcrição, e os nucléolos desaparecem.
O DNA organizador nucleolar amplificado é liberado ao citoplasma na metáfase I, onde se degrada. Nos ribossomas de eucariotos, se encontram presentes 4 tipos de RNAr: um RNA de 18S na subunidade menor e três RNAs de 28S, 5,8S e 5S na subunidade maior. A maioria das moléculas de RNA do nucléolo é RNA de 45S na parte fibrilar e 32S na granular. Os RNAr da subunidade ribossômica maior se localizam em menor quantidade na parte fibrilar, enquanto que não se encontra apenas RNAr da subunidade ribossômica menor dentro do nucléolo. A unidade de transcrição do RNA precursor do RNAr corresponde a um gene de cópias múltiplas, que forma o organizador nucleolar.
O pré-RNAr é processado no nucléolo e envolve vários passos que levam à formação das subunidades ribossômicas 40S e 60S. O processamento começa com a associação das proteínas ribossômicas ao pré-RNAr. Um precursor de 48S ou 45S é clivado para dar origem aos RNAr 18S, 28S e 5,8S da subunidade maior. Já a subunidade pequena do ribossomo (40S) é montada a partir de um RNAr l8S. Ela é terminada e enviada para o citoplasma a uma velocidade maior do que a subunidade grande (60S). Por isso, o núcleo contém uma quantidade maior de subunidades grandes que de pequenas. A subunidade grande, além dos RNAr 28S e 5,8S, derivados do pré RNAr, possui mais um RNAr pequeno (5S), constituído por 120 nucleotídeos e codificado por genes que ficam fora do nucléolo. Ele é sintetizado pela enzima RNA polimerase III, que não se encontra no nucléolo.
O nucléolo não é a única estrutura intranuclear de interesse à Biologia Celular. Já nos trabalhos de Santiago Ramón y Cajal, havia referência a estruturas intranucleares diferentes do nucléolo. Anos mais tarde, vários pesquisadores as denominaram com diferentes nomes: corpos internos, binnenkörper, corpos enovelados (pelo seu formato ao microscópio eletrônico de transmissão), entre outros. Contudo, em homenagem ao primeiro que as observou, é mais comum atualmente a menção aos corpos de Cajal.
Em 1903, Santiago Ramón y Cajal identificou, em material histológico impregnado com prata, uma série de “corpos acessórios” intranucleares. Os depósitos de prata dentro do núcleo e em estruturas pequenas ele chamou em espanhol de “cuerpo accesorio”. Poucos autores prestaram atenção em sua descoberta, acreditando que se tratava de artefato de técnica. Contudo, em 1999, foi sugerido que se ligasse o nome de Cajal ao corpo nuclear, já que ele foi o primeiro a descrevê-lo.
Uma proteína é marcadora por excelência dos corpos de Cajal, a coilina, descoberta em 1991. Vários estudos, performados em tecidos de pacientes de doenças autoimunes, responderam com uma forte coloração em imunofluorescência, em pequenos pontos com 0,1 a 2,0 μm de diâmetro, dentro do núcleo de células de mamíferos. Logo, provou-se que esses pontos correspondiam aos “corpos enovelados”, ou corpos de Cajal. A coilina está ligada ao processamento de RNA e tráfego intracelular dessa molécula. De fato, alguns RNAsno (pequenos RNAs nucleolares)e RNAsn (pequenos RNAs nucleares) são modificados nos corpos de Cajal, e esse processamento está associado à coilina.
Sabe-se que os RNAsno são responsáveis por coordenar as modificações e clivagens do pré-RNAr, sendo essenciais para a biogênese de ribossomos. Portanto, os corpos de Cajal estão ligados diretamente com a montagem dos ribossomos, em apoio ao próprio nucléolo.
A maioria das discussões sobre a função dos corpos de Cajal tem focado no próprio papel deles na montagem e modificação do processamento de RNA do núcleo, especialmente do splicing RNPsn e snoRNPs. A composição dos corpos de Cajal indica um profundo envolvimento da maquinaria de montagem e transporte dos RNAs. Em qualquer caso, o corpo de Cajal – não menos que o nucléolo – precisa agora ser considerado uma organela nuclear universal que exerce um papel fundamental na fisiologia nuclear.
Atualmente, estão sendo amplamente estudados os chamados “promyelocytic leukaemia nuclear bodies” (PML-NB), associados à repressão de tumores, defesa antiviral, estabilidade genômica, diferenciação celular, reparo do DNA e regulação transcricional. Por essa multifuncionalidade, os PML-NB são considerados “funcionalmente promíscuos”. Os PML-NB apresentam uma proteína, a SP100, que possui um domínio para recrutamento da caspase, o que coloca essa organela com um importante papel na regulação da morte celular programada.
A presença de domínios semelhantes a esse habilita os PML-NB ao sequestro e liberação de proteínas, mediante modificações pós-traducionais.
Entre as doenças ligadas aos corpos de Cajal está o Lupus Eritematoso Sistêmico (LES). Com suas típicas ulcerações orais, leucemia mieloide aguda, alergia atópica, o LES apresenta, em marcação imunocitoquímica, o desmanche estrutural dos corpos de Cajal em determinadas fases da doença. Também a atrofia muscular espinhal, que causa paralisia progressiva dos músculos, tem caráter degenerativo. Durante a degeneração dos neurônios motores na medula espinal, observam-se mutações no gene SMN1(survival motor neuron 1), que interage com a coilina dos corpos de Cajal. Quando há falta de coilina, SMN e as pequenas ribonucleoproteínas (“splicing snRNPs”) não vão para os corpos de Cajal, levando o organismo ao processo degenerativo, que culmina com a paralisia progressiva muscular.
Fonte: NORMANN e cols. Práticas em Biologia Celular. Porto Alegre, Sulina. 304 pp. 2017.


Comentários
Postar um comentário